
Sadržaj:
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Zadnja promjena 2025-01-22 16:59.
Pufer
- Ako imate samo slabu kiselina . Odredite koncentraciju kiselina (pod pretpostavkom da nema disocijacije). Potražite ili odredite Ka.
- Ako imate slabu kiselina I konjugat baza . Riješiti za tampon.
- Ako imate samo konjugat baza . Riješiti za pH vrijednosti baza koristeći Kb i jednadžba hidrolize.
U skladu s tim, kako provodite kiselo-baznu titraciju?
Postupak titracije
- Isperite biretu standardnom otopinom, pipetu nepoznatom otopinom, a konusnu tikvicu destiliranom vodom.
- Stavite točno izmjereni volumen analita u Erlenmeyerovu tikvicu pomoću pipete, zajedno s nekoliko kapi indikatora.
Isto tako, kako izračunati titraciju? Koristiti formula za titraciju . Ako titrant i analit imaju molski omjer 1:1, formula je molarnost (M) kiseline x volumen (V) kiseline = molarnost (M) baze x volumen (V) baze. ( Molarnost je koncentracija otopine izražen kao broj molova otopljene tvari po litri otopine.)
Osim toga, je li S F jaka ili slaba baza?
Stoga, I- je najstabilniji, a najmanje osnovni, dok F - najmanje je stabilan i najosnovniji. Jake baze u potpunosti komunicirati s jaka kiseline poput HCl da u reakciji neutralizacije tvore sol i vodu. Ostalo jake baze su topljivi oksidi, poput Na2O i topljive hidroksidne soli. Jake baze su jaka elektroliti.
Za što se koristi titracija?
A titracija je tehnika u kojoj je otopina poznate koncentracije naviknut odrediti koncentraciju nepoznate otopine. Tipično, titrant (poznata otopina) se dodaje iz birete u poznatu količinu analita (nepoznata otopina) dok se reakcija ne završi.
Preporučeni:
Koji su koraci uključeni u galvanizaciju?

U nastavku su opisani koraci koji se poduzimaju u tipičnom procesu galvanizacije cinka. Korak 1 – Čišćenje podloge. Korak 2 – Aktivacija supstrata. Korak 3 – Priprema otopine za oblaganje. Korak 4 – galvanizacija cinka. Korak 5 – Ispiranje i sušenje
Koji su koraci puta prijenosa signala?
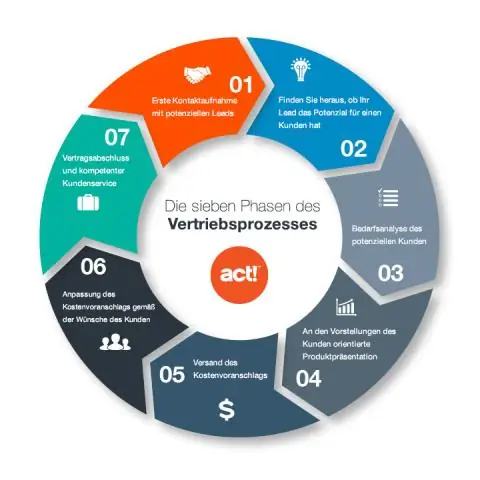
Tri stupnja stanične signalizacije Ćelijska signalizacija se može podijeliti u 3 stupnja. Prijem: Stanica detektira signalnu molekulu s vanjske strane stanice. Transdukcija: Kada signalna molekula veže receptor, ona na neki način mijenja receptorski protein. Odgovor: Konačno, signal pokreće specifičan stanični odgovor
Koji su koraci erozije?

Tri koraka zajednička za eroziju vode i vjetra: ODJELJIVANJE čestica tla: Ova radnja uklanja čestice iz tla udarnom energijom kiše ili vjetra. TRANSPORT čestica: Ovo djelovanje nosi čestice tla u pokretnom vjetru ili vodi. DEPOZICIJA čestica na novo mjesto:
Koji su koraci za rješavanje riječnih problema?
Jednostavni koraci za rješavanje Word problema Pročitajte problem. Započnite pažljivim čitanjem problema. Identificirajte i navedite činjenice. Shvatite točno što problem traži. Uklonite višak informacija. Obratite pažnju na mjerne jedinice. Nacrtajte dijagram. Pronađite ili razvijte formulu. Posavjetujte se s referencom
Koji plin nastaje kada se željezni sulfid tretira razrijeđenom sumpornom kiselinom?

Kada željezni sulfid reagira s razrijeđenom sumpornom kiselinom, nastaje sumporovodik koji se skuplja u plinskoj posudi pomicanjem zraka prema gore
