
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Zadnja promjena 2025-01-22 16:59.
The entalpija formiranja za element u svom elementarnom stanju uvijek će biti 0 jer nije potrebna energija za stvaranje spoja koji se pojavljuje u prirodi. Kad je tvar formirana od najstabilnijeg oblika njegova elementi , promjena u entalpija odvija se.
Slično se može pitati, koje tvari imaju entalpiju stvaranja nula?
Svi elementi u svom standardnom stanju (plin kisik, krutina ugljik u obliku grafit , itd.) imaju standardnu entalpiju formiranja nula, budući da nema promjena uključenih u njihovo nastajanje.
Potom se postavlja pitanje kolika je entalpija stvaranja vode? Odabrana ATcT entalpija formiranja na temelju verzije 1.118 Thermochemical Network
| Ime vrste | Formula | ΔfH°(298,15 K) |
|---|---|---|
| Voda | H2O (cr, eq.press.) | -292.740 |
Sukladno tome, zašto standardna entalpija formiranja dijamanta nije nula iako je element?
The standardna entalpija formiranja za element u svom standard država je NULA !!!! Dakle, ΔH°f za C (s, grafit) je nula , ali ΔH°f za C (s, dijamant ) je 2 kJ/mol. To je zato što je grafit standard stanje za ugljik, ne dijamant.
Što to znači kada je Delta h nula?
Mogu mjeriti samo promjene entalpije. Kada je entalpija pozitivna i delta H je veći od nula , ovo sredstva da je sustav apsorbirao toplinu. To se naziva endotermna reakcija. Kada je entalpija negativna i delta H je manje od nula , ovo sredstva da sustav oslobađa toplinu. To se zove egzotermna reakcija.
Preporučeni:
Zašto je inducirana emf nula kada je magnetski tok maksimalan?

Kada je zavojnica uspravna, nema promjene u magnetskom toku (tj. emf=0) jer zavojnica ne 'siječe' linije polja. Inducirana emf je nula kada su zavojnice okomite na linije polja i maksimalna kada su paralelne. Zapamtite, inducirani emf je brzina promjene veze magnetskog toka
Zašto je EMF nula kada zavojnica prolazi kroz točno središte magneta?
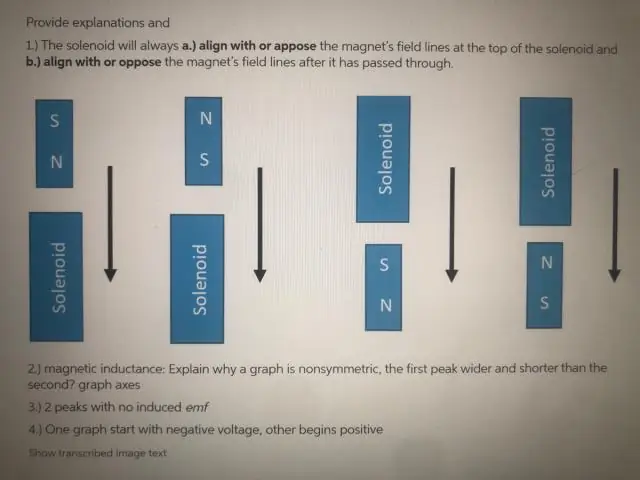
EMF je samo na trenutak nula dok magnet prolazi kroz točno središte zavojnice. To je zato što je učinak N pola na jednom kraju magneta na tom kraju zavojnice, točno poništen učinkom S pola magneta na drugom kraju zavojnice
Kolika je entalpija nastanka Caoa?

Tablica topline nastanka spoja ΔHf (kJ/mol) CaCO3 -1207,0 CaO(s) -635,5 Ca(OH)2(s) -986,6 CaSO4(s) -1432,7
Kako se obilje elemenata na Zemlji može usporediti s obiljem elemenata u ljudima?

Kisik je najzastupljeniji element i na Zemlji i u Ljudima. Obilje elemenata koji tvore organske spojeve raste kod ljudi, dok se brojnost metaloida povećava na Zemlji. Elementi kojih ima u izobilju na Zemlji neophodni su za održavanje života
Zašto se zamuljena podzemna voda smatra znakom nastanka vrtača?

Vrtače su sve o vodi. Voda je otopila minerale u stijeni, ostavljajući ostatke i otvorene prostore unutar stijene. Voda ispire tlo i ostatke iz šupljina u stijeni. Snižavanje razine podzemne vode može uzrokovati gubitak potpore za mekani materijal u stijenskim prostorima što može dovesti do urušavanja
