
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Zadnja promjena 2025-01-22 16:59.
7 obveznica
Slično, stvara li fluor kovalentne veze?
S drugim atomima, oblici fluora bilo polarni kovalentne veze ili ionski obveznice . Najčešće, kovalentne veze koji uključuje fluor atomi su pojedinačni obveznice , iako barem dva primjera višeg reda veza postojati.
Isto tako, koliko kovalentnih veza ima? tri kovalentne veze
Osim ovoga, kako odrediti koliko kovalentnih veza ima element?
Broj obveznice za neutralnog atom je jednak broju elektrona u punoj valentnoj ljusci (2 ili 8 elektrona) minus broj valentnih elektrona. Ova metoda djeluje jer svaki kovalentna veza da an atom tvori dodavanje još jednog elektrona u valentnu ljusku atoma bez promjene njegovog naboja.
Jesu li kovalentne veze jake?
Kovalentne veze se također nalaze u anorganskim molekulama poput H2O, CO2, i O2. Jedan, dva ili tri para elektrona mogu se dijeliti, čineći jednostruke, dvostruke i trostruke obveznice , odnosno. Više kovalentne veze između dva atoma, tj jači njihova povezanost. Dakle, trostruko obveznice su najjači.
Preporučeni:
Je li vodikova veza isto što i kovalentna veza?
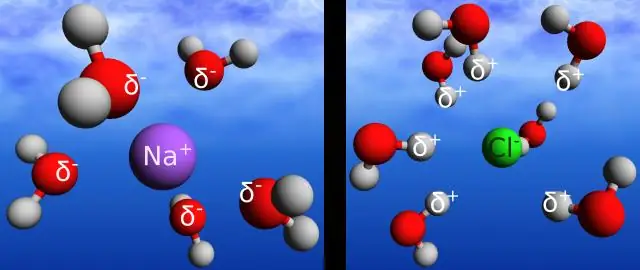
Vodikova veza je naziv za elektrostatičku interakciju između pozitivnog naboja na atomu vodika i negativnog naboja na atomu kisika susjedne molekule. Kovalentna veza je elektrostatička interakcija između dva atoma u istoj molekuli
Kako pronaći broj kovalentnih veza u spoju?

Broj veza za neutralni atom jednak je broju elektrona u punoj valentnoj ljusci (2 ili 8 elektrona) umanjenom za broj valentnih elektrona. Ova metoda funkcionira jer svaka kovalentna veza koju atom formira dodaje još jedan elektron valentnoj ljusci atoma bez promjene naboja
Kakva je struktura kovalentnih veza?

Kovalentna veza nastaje kada se par elektrona podijeli između dva atoma. Ovi zajednički elektroni nalaze se u vanjskim omotačima atoma. Općenito, svaki atom daje jedan elektron zajedničkom paru elektrona
Koliko s veza ima C u co2?

2 sigma veze
Koliko veza ima sumpor?

Sumpor obično stvara 2 veze, na pr. H2S, -S-S-spojevi To je zbog njegove 3p4 orbitale. p-orbitale dopuštaju da se popuni 6 mjesta, stoga sumpor ima tendenciju formiranja 2 veze. Može 'proširiti oktet' jer ima 6 valentnih elektrona, čime se dopušta stvaranje 6 veza
