
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Zadnja promjena 2025-06-01 05:04.
6.4
Također je upitan, koliki je pKa tiola?
tioli kiseliji su od alkohola u prosjeku za oko 5 pKa jedinice ili tako ( pKa od oko 11 za tiol na slici ispod). Zapamti to pKa je logaritamski, pa to znači da su oko 105 puta kiseliji.
Također znajte, koliki je pKa aldehida? C-H veza nije obično kisela. Zbog rezonantne stabilizacije konjugatne baze, α-vodik u an aldehida (nije prikazan na gornjoj slici) je daleko kiseliji, s pKa blizu 17, u usporedbi s kiselošću tipičnog alkana (pKa oko 50).
Zatim, koja je približna pKa vrijednost etanola?
Kad su spojevi jednako slabo kiseli u voda kao etanol, počinjemo mjeriti njihovu kiselost prema njihovim pKa vrijednostima, a ne njihovim Ka vrijednostima. Vrijednost pKa etanola je oko 15,9.
Što znači pKa?
Ključni za ponijeti: pKa Definicija The pKa vrijednost je metoda koja se koristi za označavanje jačine kiseline. pKa je negativni log konstante disocijacije kiseline ili Ka vrijednost. A niže pKa vrijednost ukazuje na jaču kiselinu. To jest, niža vrijednost ukazuje da se kiselina potpunije disocira u vodi.
Preporučeni:
Koliki je približni raspon dubine plašta?

255 milja Nakon toga, može se također zapitati, koliki je približni raspon dubine vanjske jezgre? The vanjska jezgra , debljine oko 2 200 kilometara (1 367 milja), uglavnom se sastoji od tekućeg željeza i nikla. NiFe legura od vanjska jezgra je vrlo vruće, između 4.
Koliki je pKa amida?

Osnovnost. U usporedbi s aminima, amidi su vrlo slabe baze. Dok konjugirana kiselina amina ima pKa od oko 9,5, konjugirana kiselina amida ima pKa oko −0,5. Stoga amidi nemaju tako jasno uočljiva kiselinsko-bazna svojstva u vodi
Koliki je pKa jakih kiselina?

Jake kiseline definirane su njihovim pKa. Kiselina mora biti jača u vodenoj otopini od hidronijevog iona, tako da njezin pKa mora biti niži od hidronijevog iona. Stoga jake kiseline imaju pKa <-174
Zašto pufer najbolje djeluje pri pH blizu svog pKa?
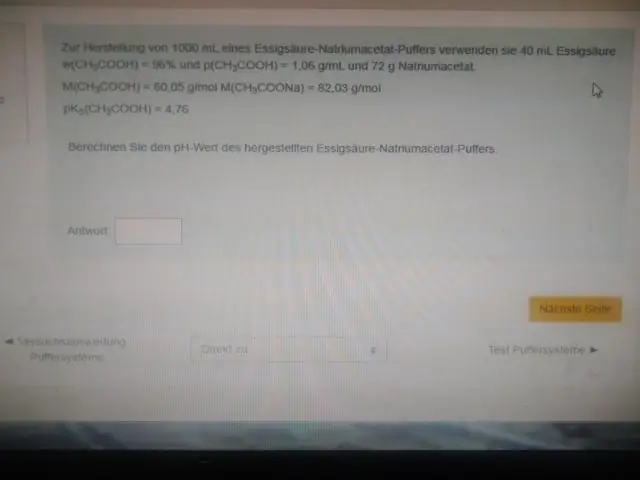
Drugim riječima, pH ekvimolarne otopine kiseline (npr. kada je omjer koncentracije kiseline i konjugirane baze 1:1) jednak je pKa. Ovo područje je najučinkovitije za otpornost na velike promjene pH kada se dodaju kiselina ili baza. Titracijska krivulja vizualno pokazuje kapacitet pufera
Je li niži pKa stabilniji?

PKa je sličan pH po tome što niske (pa čak i negativne vrijednosti) označavaju jake kiseline. To je zato što se pKa temelji na ravnoteži: prema ovome, sve što stabilizira konjugiranu bazu povećat će kiselost. Stoga je pKa također mjera koliko je konjugirana baza stabilna
